Промежуточные результаты «Народного исследования» вакцины Спутник-V (Гам-КОВИД-Вак-2020)
Снова не про спорт.
Вакцинироваться или переболеть, авось пронесет. Каждый решает сам.
Часть первая на sports.ru
Часть первая на LiveJournal
*******************************
В настоящее время в публичном доступе находится лишь незначительное количество обобщенной, достоверной информации о вакцине Спутник-V.
Можно отметить статью в англоязычном научном журнале Ланцет о результатах 1/2 фазы испытаний, в части данных по безопасности и иммуногенности, а также инструкцию к препарату на сайте Государственного реестра лекарственных средств, в части данных о побочных действиях. Плановое завершение 3 фазы клинических испытаний вакцины намечено на 1 мая 2021 года, крупных публикаций от разработчика вакцины НИЦЭМ им.Н.Ф.Гамалеи до окончания клинических испытаний (КИ) ожидать не следует. В связи чем появляется актуальность параллельного сбора и обобщения данных о вакцине Гам-КОВИД-Вак-2020.
Характеристика выборки
Народные исследования вакцины Спутник-V проводятся сообществом t.me/covid_dobrovolec. Сообщество является открытой площадкой, где участники 3 фазы клинических испытаний вакцины публикуют результаты тестов и отзывы о самочувствии после инъекций.
На текущий момент «Народного исследования» (15 декабря 2020 года) обработаны данные 481 испытателя. Для повышения достоверности в обработку включены отзывы только тех испытателей, которые представили графическое отображение результатов тестов.
В общей сложности испытателями представлены 875 результатов анализов SARS-COV-2, включая тесты на антитела IgG к S-белку и RBD, антитела IgG к нуклеокапсиду (N-белку), совместные тесты IgG к N и S-белку, тесты на антитела IgM, тесты ПЦР, тесты на Т-клеточный иммунитет.
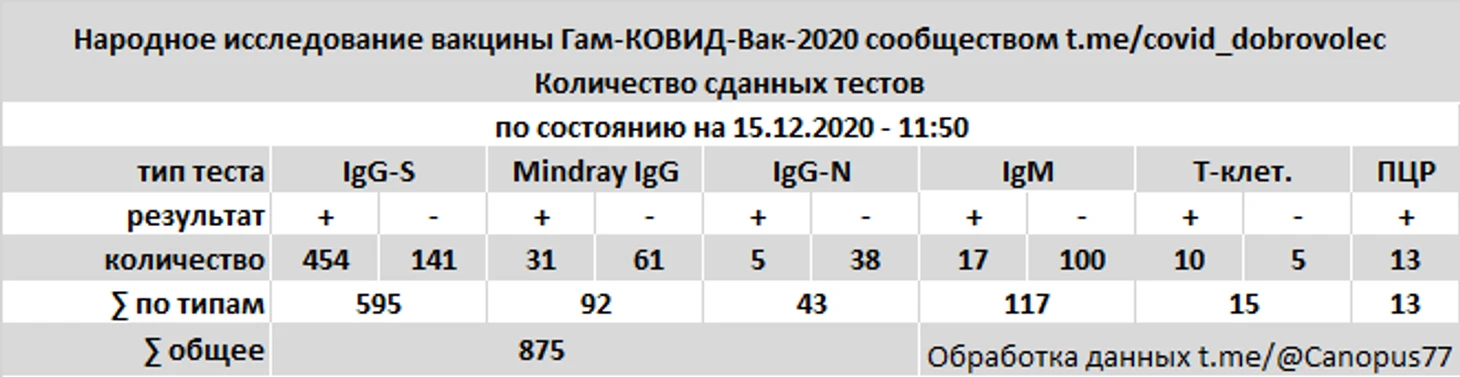
Тестирование происходило по личной инициативе и за счёт испытателей, в сроки и лабораториях выбранных самими испытателями.
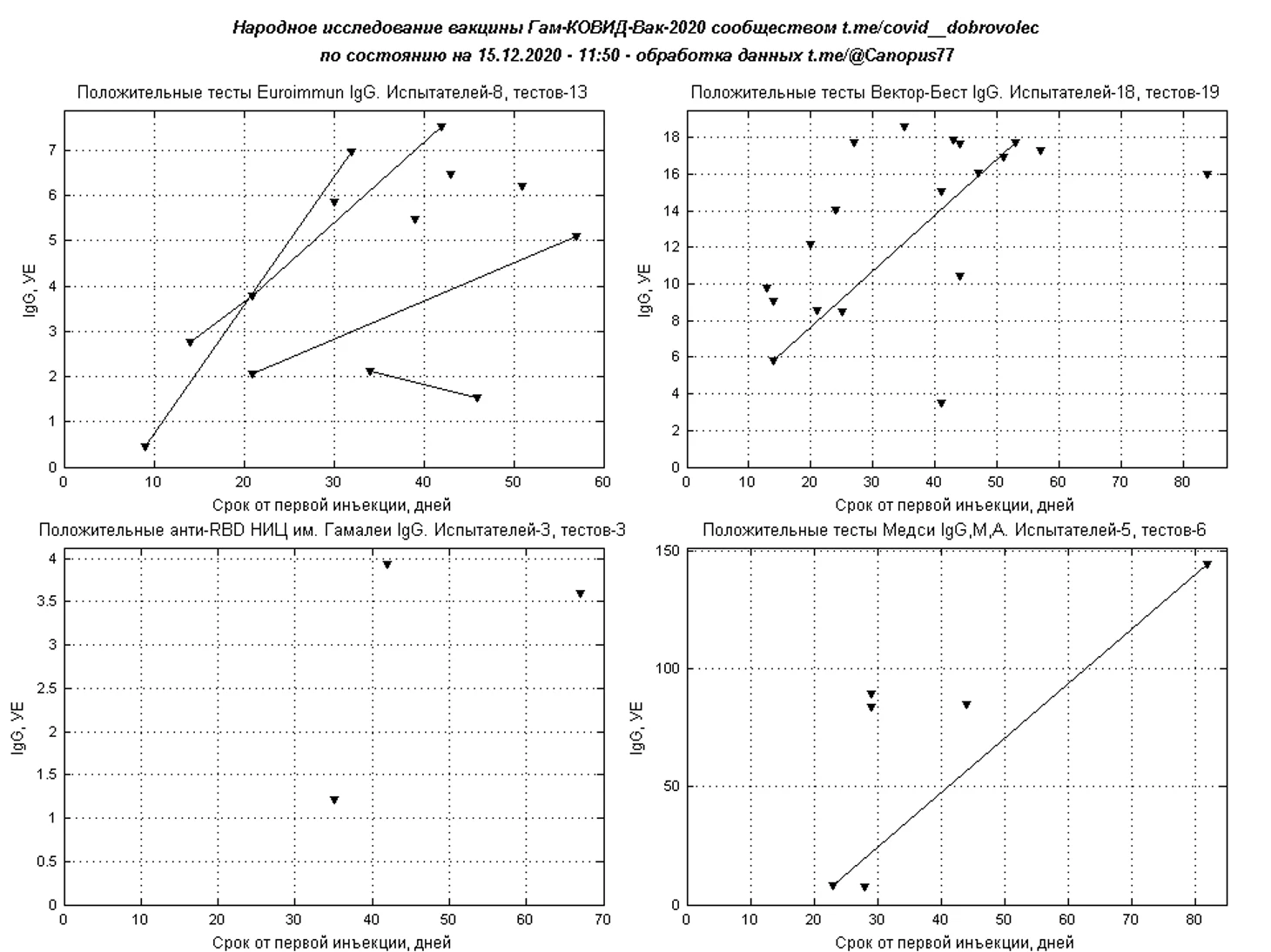
На антитела IgG к S-белку и RBD проводились тестирование в системах Liaison XL SARS-CoV-2 Diasorin, Вектор-Бест SARS-CoV-2-IgG-ИФА-БЕСТ, Euroimmun Anti-SARS-CoV-2 ELISA, Beckman Coulter Access SARS-CoV-2, НИЦЭМ им. Н. Ф. Гамалеи Анти-RBD, суммарный тест Медси IgA-IgM-IgG.
На антитела IgG к нуклеокапсиду сдавались тесты Abbott Architect SARS-CoV-2 IgG.
На антитела IgM проводилось тестирование Вектор-Бест SARS-CoV-2-IgM-ИФА-БЕСТ, Abbott Architect SARS-CoV-2 IgM, Mindray IgM (поликлиники г. Москвы).
Совместный тест на антитела IgG к N и S-белку - Mindray IgG (поликлиники г. Москвы).
Ввиду неопределенности данных испытателей о типе инъекции вакцина либо плацебо, классификация испытателей в категорию «вакцина» осуществлялась по наличию положительного теста IgG к S-белку или RBD, при одновременном наличии положительного теста антител IgG к N-белку, выработка которых происходит только после заболевания, испытатель из категории исключался, при наличии положительного теста ПЦР до положительного теста IgG к S-белку или RBD испытатель также исключался из категории.
Таким образом, из 481 участников в категорию «вакцина» было распределено 358 испытателей, включая троих участников гражданской вакцинации, что составляет 74,4% от выборки и близко к распределению КИ по группам вакцина/плацебо.
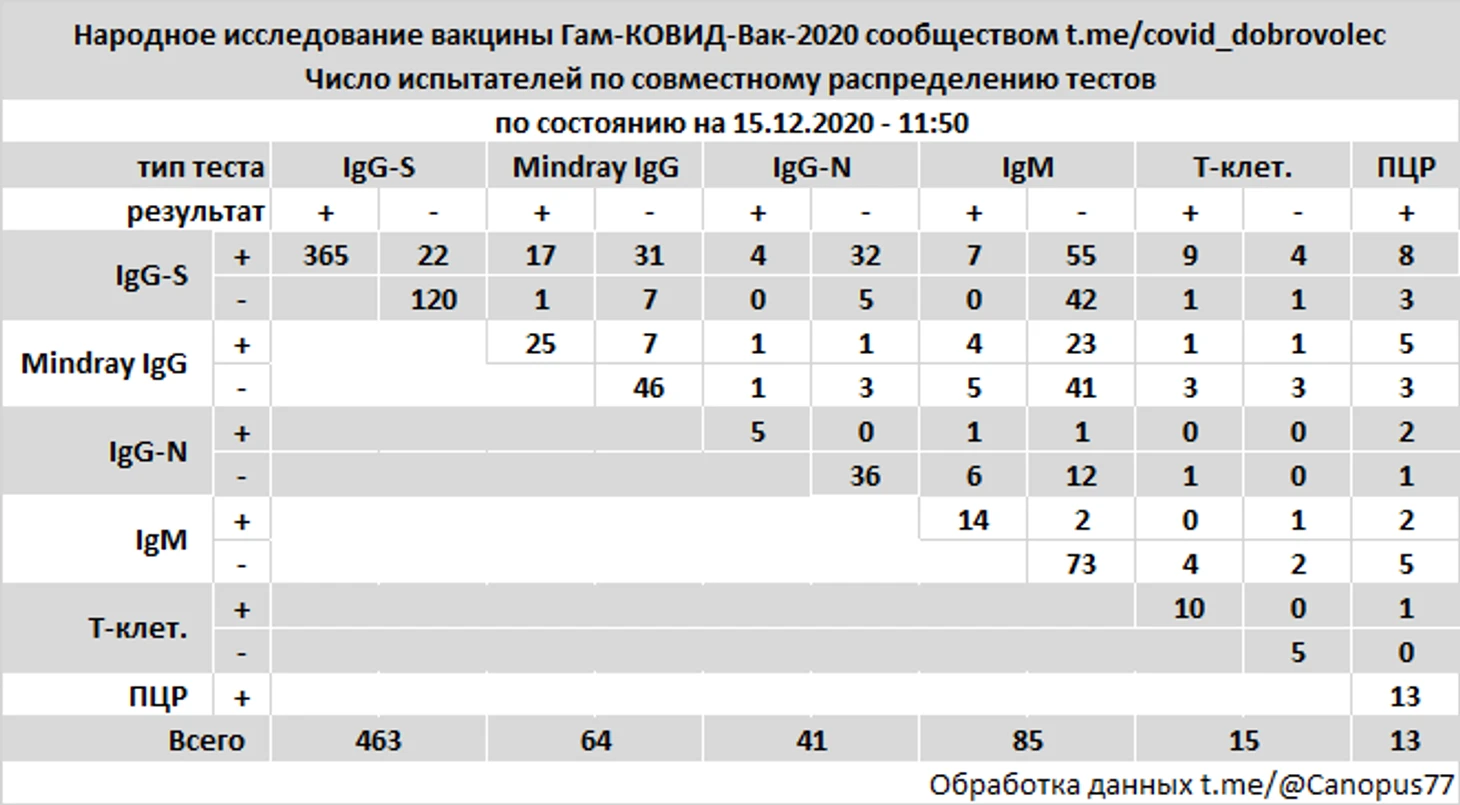
Из 365 участников с положительными тестами IgG к S-белку четверо имели положительные IgG к N-белку, восемь положительные ПЦР, причем у двоих из восьми положительные ПЦР были обнаружены после положительных IgG к S-белку, на 59 и 64 дни от первой инъекции.
У 22 участников отрицательные тесты IgG к S-белку были перекрыты положительными тестами на более поздних сроках.
Из 13 участников имевших положительные тесты на IgG к S-белку и тесты на Т-клеточный иммунитет у девяти (69%) Т-клеточный анализ был положительным.
У одной участницы при положительных тестах на IgG к S-белку и Т-клеточный иммунитет позже был выявлен Covid-19, подтвержденный ПЦР.
Оценить эффективность вакцины по соотношению заболевших в группах плацебо и вакцина не представляется возможным, ввиду отсутствия достоверных сведений о распределении участников по группам.
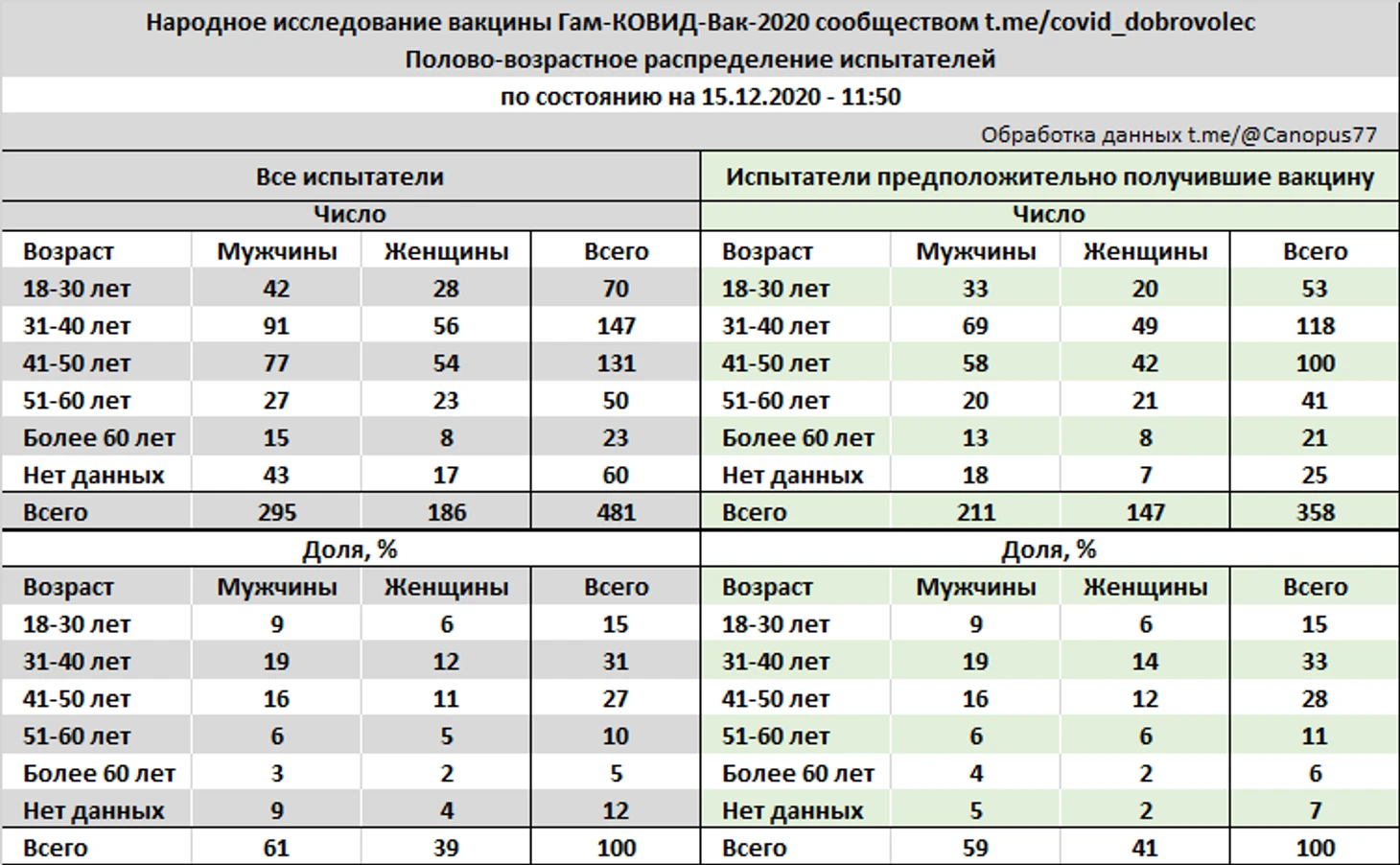
Полово-возрастное распределение испытателей, в соответствии с возрастными категориями определенными официальным протоколом 3 фазы клинических испытаний вакцины, следующее:
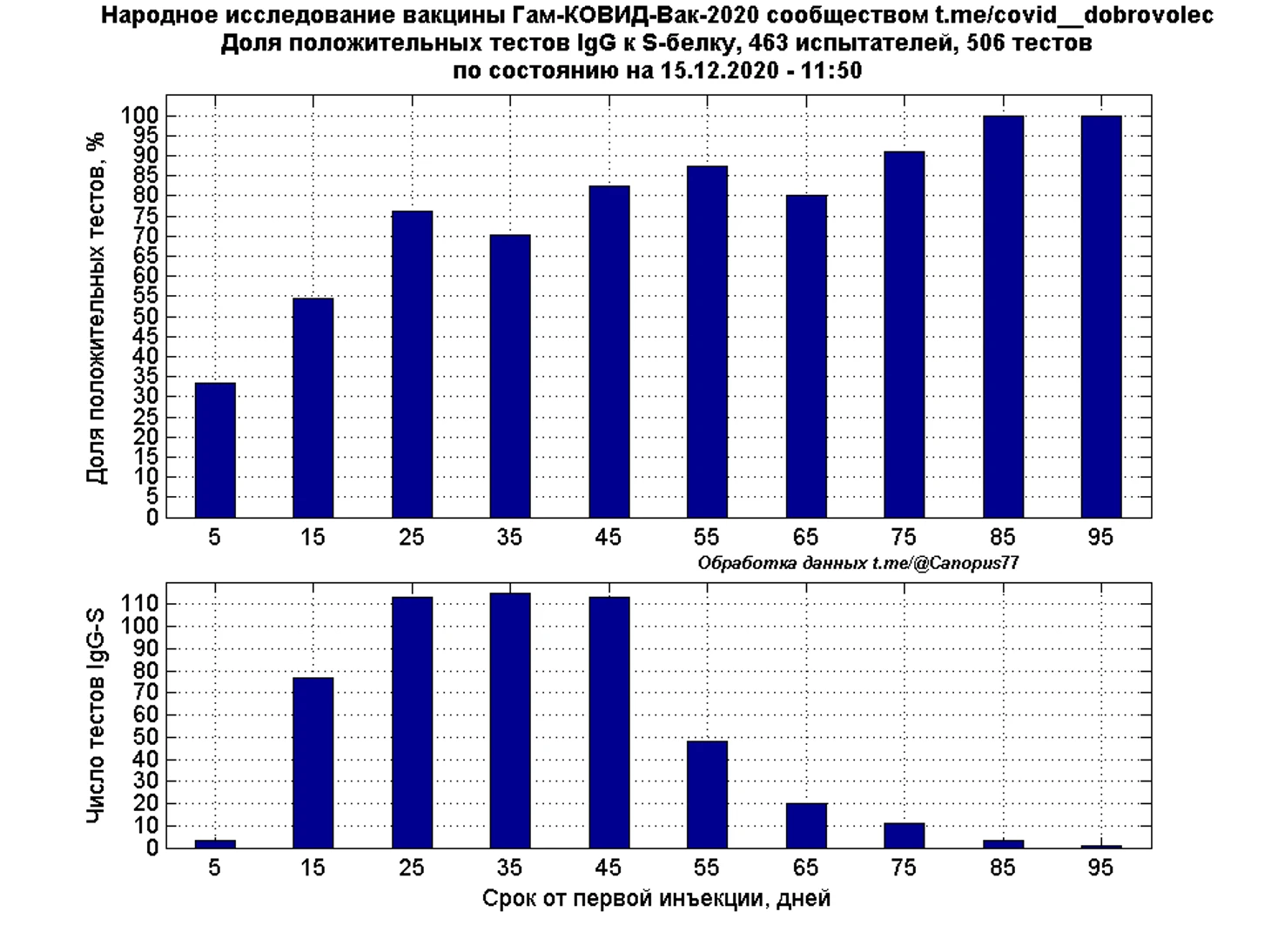
Оценка иммуногенности
Анализ доли положительных тестов IgG к S-белку или RBD по декадам относительно дня первой инъекции показывает, высокий иммунный ответ на третьей декаде, где доля положительных тестов составила 76%, что близко к распределению КИ по группам вакцина/плацебо, в первую декаду отмечается недостаточное число тестов для достоверной оценки, вторая декада характеризуется 54% долей положительных тестов, что при учёте соотношения вакцина плацебо позволяет предположить об иммунном ответе у 72% испытуемых получивших вакцину. Методика подсчета предполагала учет всех отрицательных тестов IgG к S-белку и первого положительного, снижение доли положительных тестов на четвертой декаде связано с повторными тестами испытателей, получивших отрицательные тесты ранее (предположительно получившие плацебо).
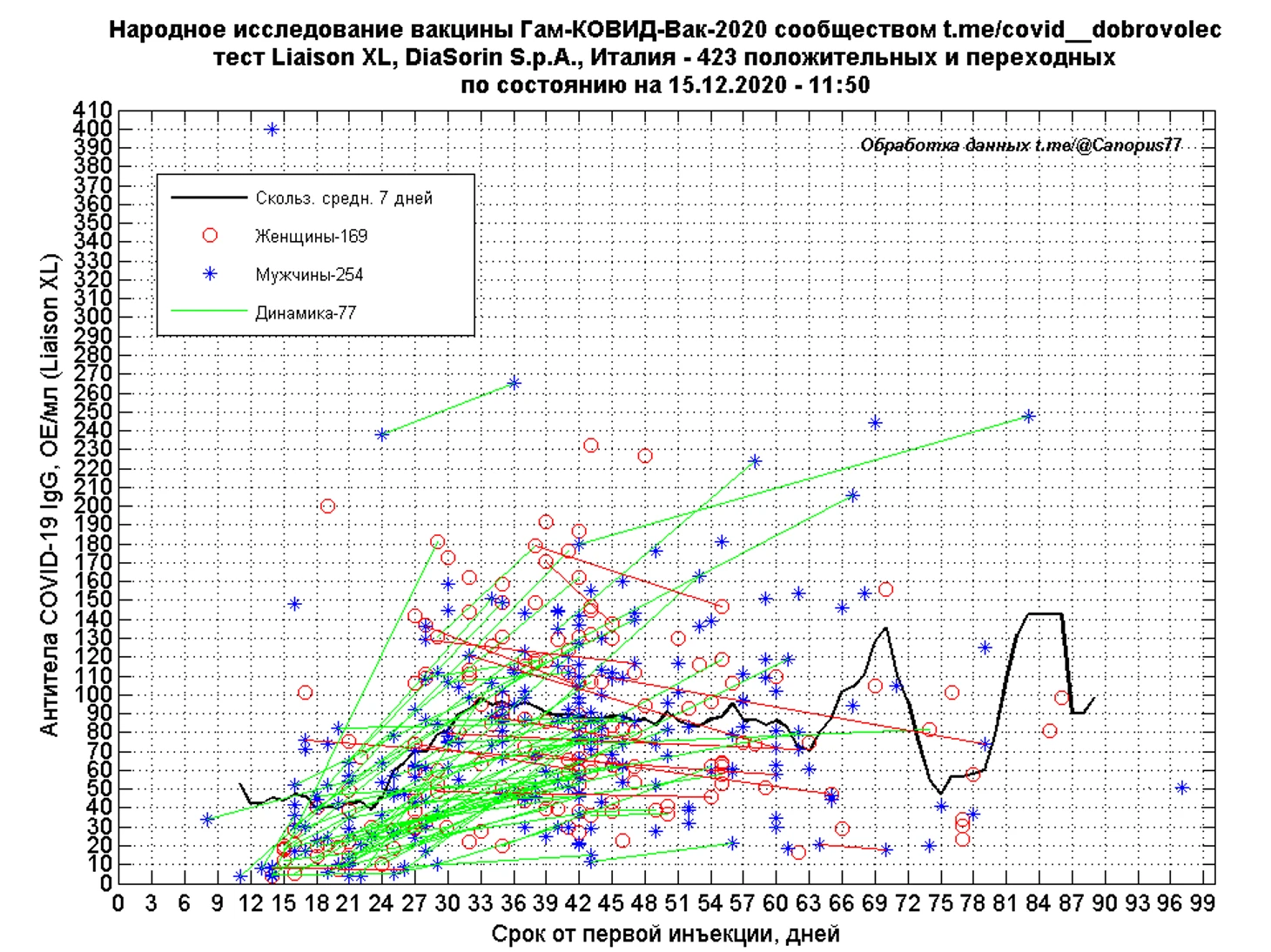
Наибольшее число тестирований проведено с использованием тест-системы Liaison XL SARS-CoV-2 Diasorin, число положительных и переходных результатов составило 423, где под переходными понимаются персональные отрицательные либо сомнительные результаты испытателя, получившего в дальнейшем положительный тест.
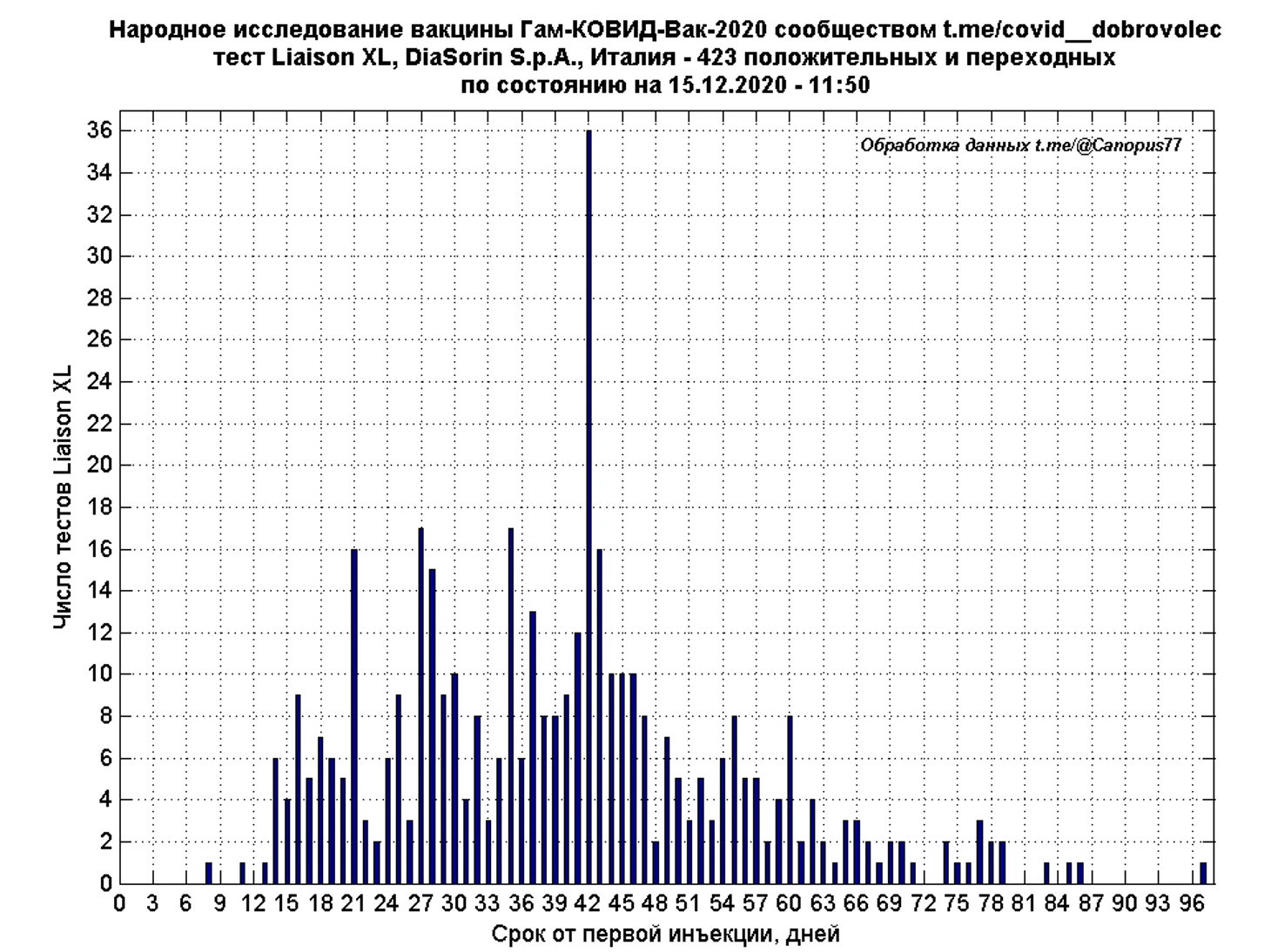
Временной ход количественного уровня IgG ОЕ/мл результатов Liaison XL, сглаженный 7-дневным скользящим средним, показывает рост иммунного ответа до 33 дня, с последующим незначительным снижением. Средний уровень IgG на 33 день составляет 98,2 ОЕ/мл.
Оценка безопасности
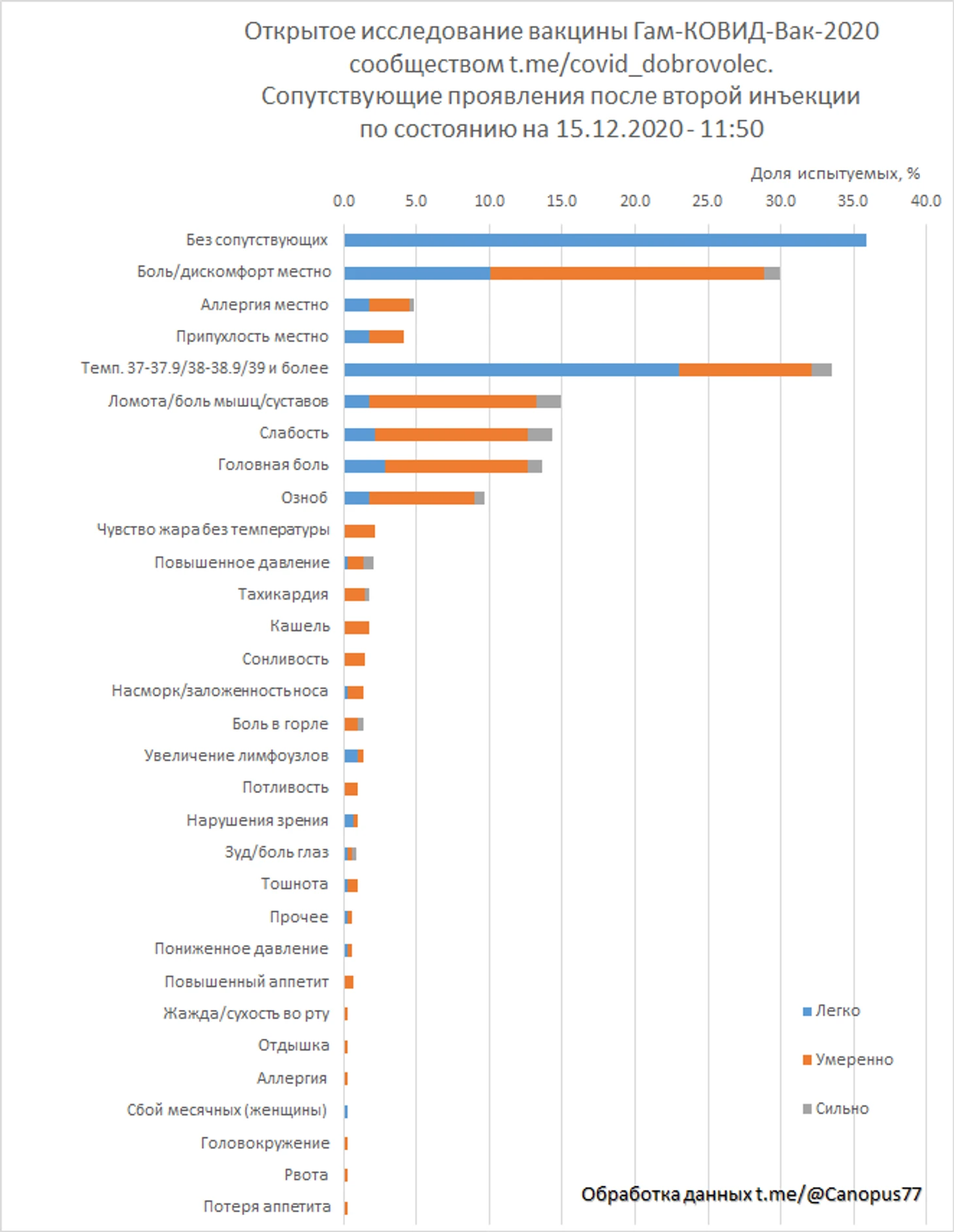
Оценка безопасности проводилась определением категорий и числа нежелательных сопутствующих проявлений, упомянутых в отзывах испытателей. Проявления градуировались по трем градациям «легко», «умеренно», «сильно». К градации «легко» были отнесены упоминания с характеристиками «легко», «слабо», «незначительно», «побаливало», «мало заметно», к градации «сильно» с характеристиками «сильно», «ужасно», «очень», к градации «умеренно» прочие упоминания. Повышение температуры градуировано по значениям от 37 до 37.9°С, от 38 до 38.9°С и 39°С и более.
Проявления отмечены по 3 местным категориям и 29 общим, отдельно посчитаны отзывы с указанием отсутствия побочных явлений.
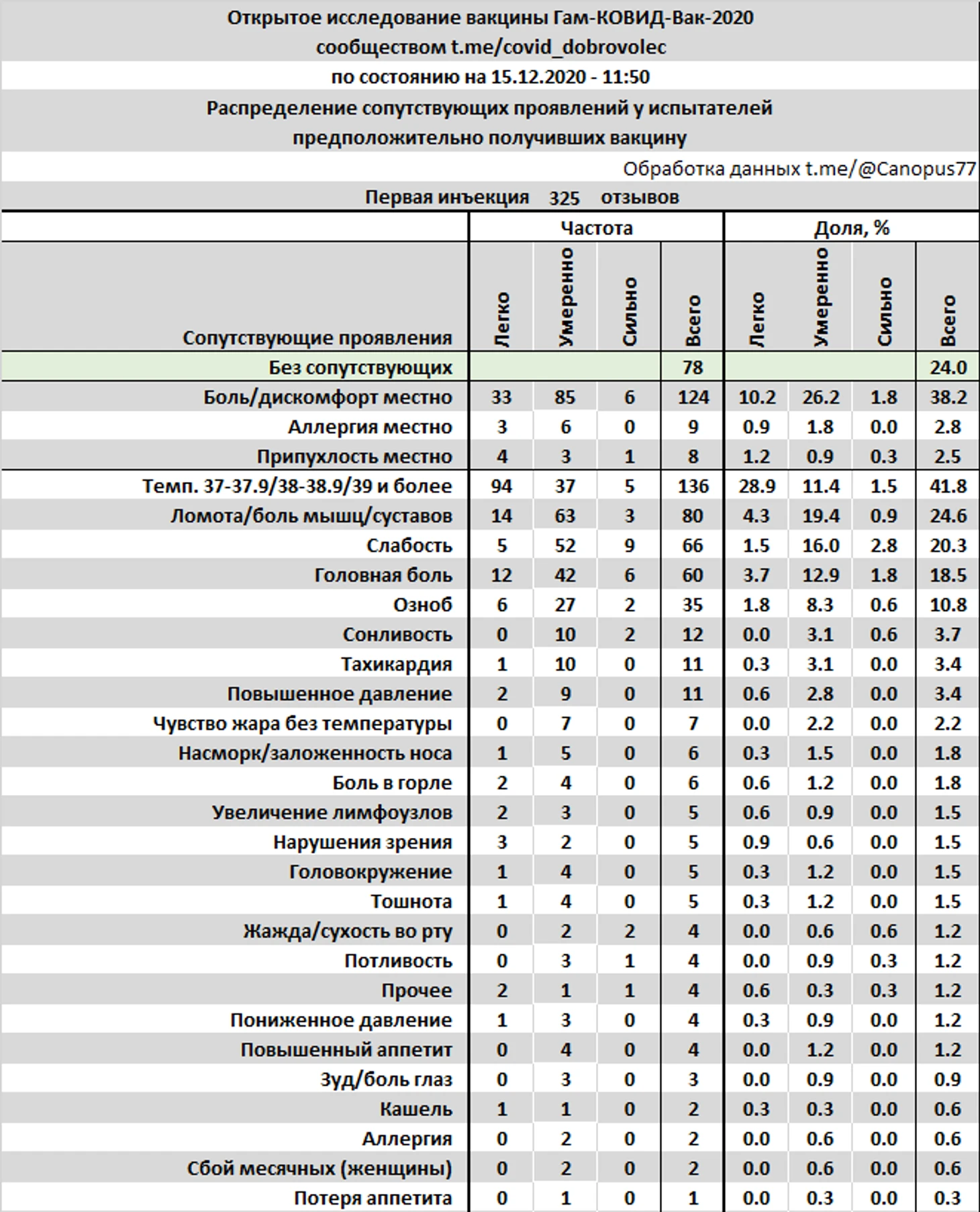
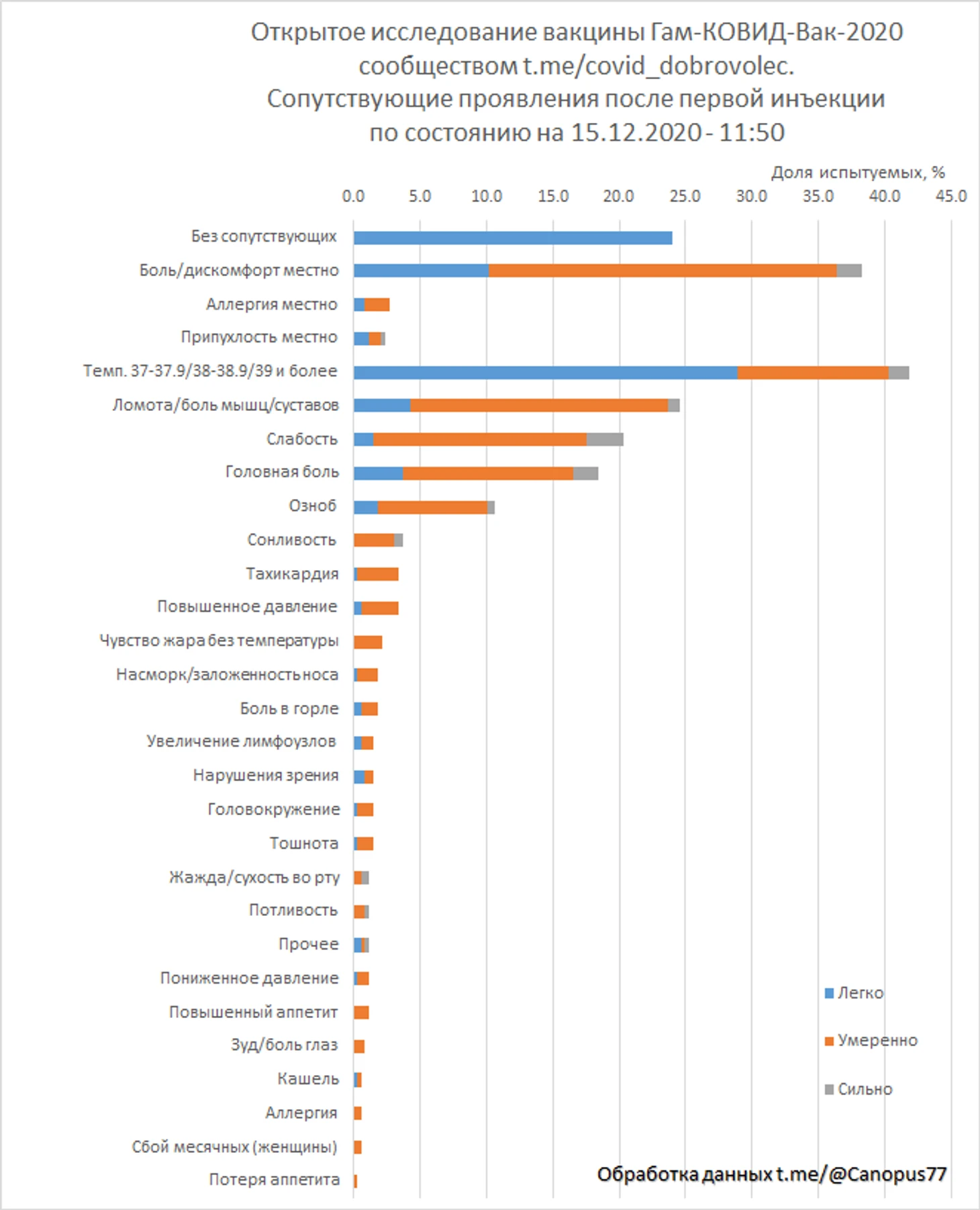
Испытатели, распределенные в предполагаемую группу «вакцина», оставили 325 отзывов о сопутствующих проявлениях после первой инъекции.
24% испытуемых отметили полное отсутствие нежелательных проявлений, 41.8% отмечали повышенную температуру, в том числе 1.5% температуру 39°С и более, 38.2% отмечали боль или дискомфорт места инъекции. Тяжелых побочных явлений не зафиксировано.
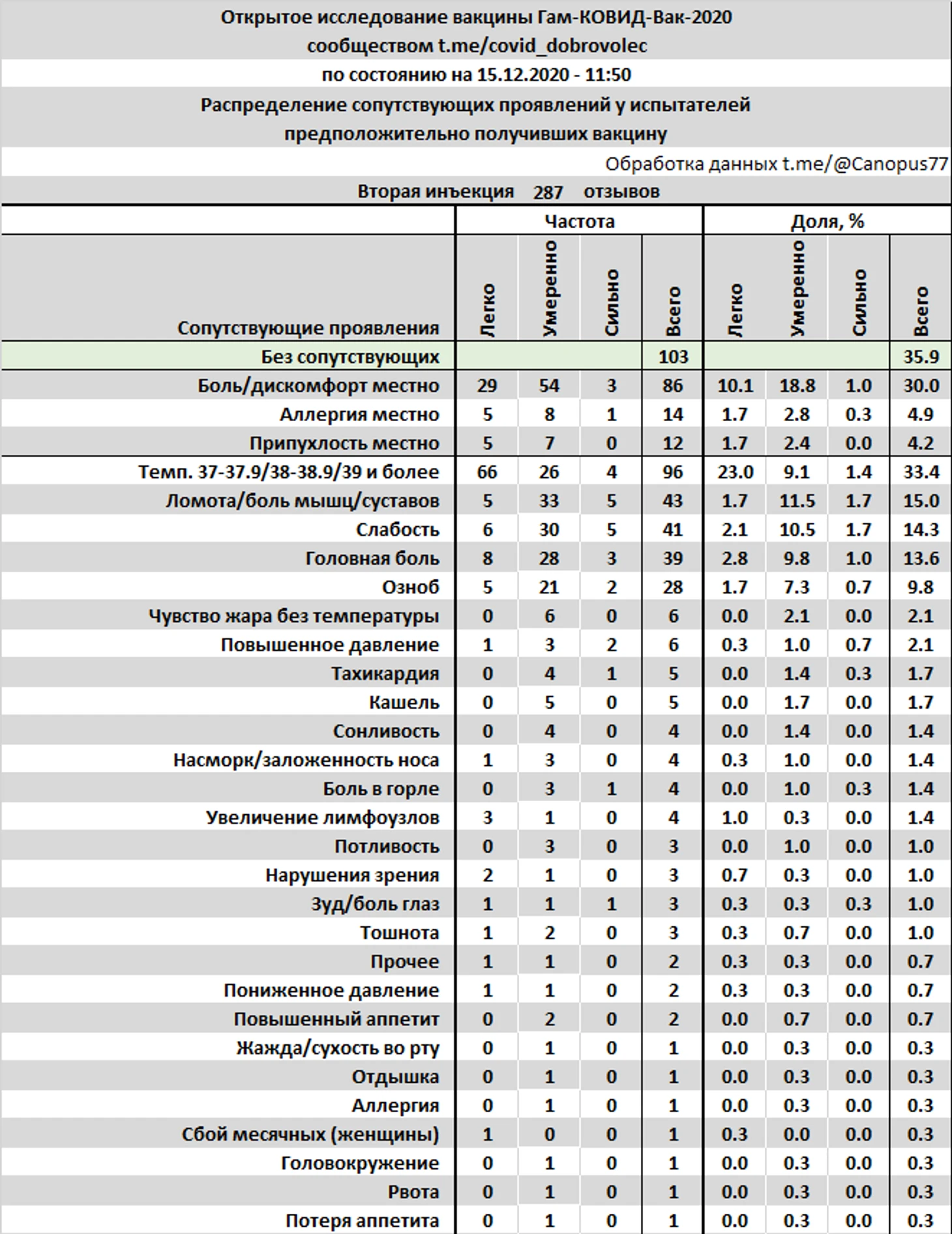
287 отзывов было оставлено испытателями, предполагаемой группы «вакцина», о сопутствующих проявлениях после второй инъекции.
35% испытуемых отметили полное отсутствие нежелательных проявлений, 33.4% отмечали повышенную температуру, в том числе 1.4% температуру 39°С и более, 30% отмечали боль или дискомфорт места инъекции. Тяжелых побочных явлений не зафиксировано.
Выводы:
1. У 74.4% испытателей общей выборки (при доле вакцины в КИ 75%) выявлены антитела к S-белку коронавируса SARS-CoV-2.
2. Сроком появления антитела к S-белку коронавируса SARS-CoV-2 у 75% испытателей общей выборки (при доле вакцины в КИ 75%) является третья декада от момента первой инъекции.
3. Максимальный количественный уровень антител к S-белку коронавируса SARS-CoV-2 продуцируется на 33 день от момента первой инъекции.
4. После первой инъекции у 76% испытателей, с продуцированными антителами к S-белку коронавируса SARS-CoV-2, наблюдались побочные проявления, преимущественно в легкой и умеренной форме.
5. После второй инъекции у 64.1% испытателей, с продуцированными антителами к S-белку коронавируса SARS-CoV-2, наблюдались побочные проявления, преимущественно в легкой и умеренной форме.
6. У двух испытателей с продуцированными антителами к S-белку коронавируса SARS-CoV-2 зафиксирован положительный тест ПЦР, однако, нет возможности оценить эффективность вакцины, ввиду отсутствия достоверных сведений о распределении участников по группам вакцина/плацебо.
Приложение: Особенности интерпретация тестов Mindray IgG
В начале «Народного исследования» существенное затруднение в интерпретации результатов тестов вызывало незнание факта, что производными вакцинации являются нейтрализующие антитела IgG к S-белку или RBD, определяемые не всеми тест-системами SARS-CoV-2 и анализы сданные в муниципальных учреждения здравоохранения города Москвы наталкивали испытателей на ложные выводы о низкой иммуногенности вакцины. С накоплением данных тестов Liaison XL и Mindray IgG удалось установить некоторые особенности интерпретации поликлинических тестов.
Сопоставлением 28 парных тестов Liaison XL и Mindray IgG, со смещение по времени не более 7 дней и средним смещение 2 дня на более ранний период для теста Mindray IgG, было установлена зависимость показаний тестов. При этом отмечались аномальные «выбросы» значений Mindray IgG у испытуемых с положительными тестами IgG к N-белку либо имевших положительные результаты ПЦР, соответствующие значения Mindray IgG более 100 Ед/мл в регрессионную оценку не включались.
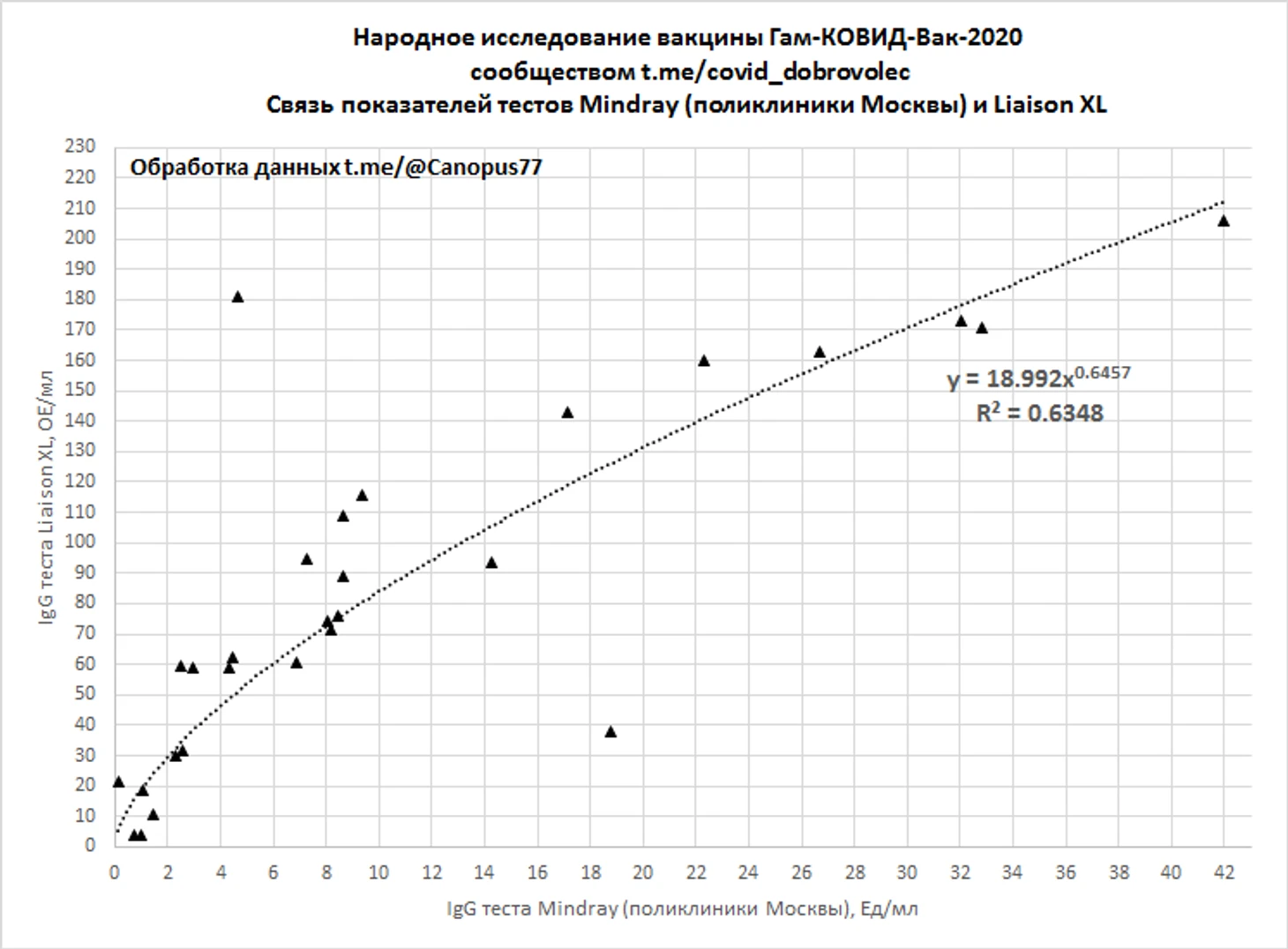
У большинства испытателей с положительными результатами IgG к S-белку отмечается рост показаний теста Mindray IgG, часто не превышающий референсное значение 10 Ед/мл. Численная оценка «положительных» изменений результатов Mindray IgG будет произведена дополнительно.
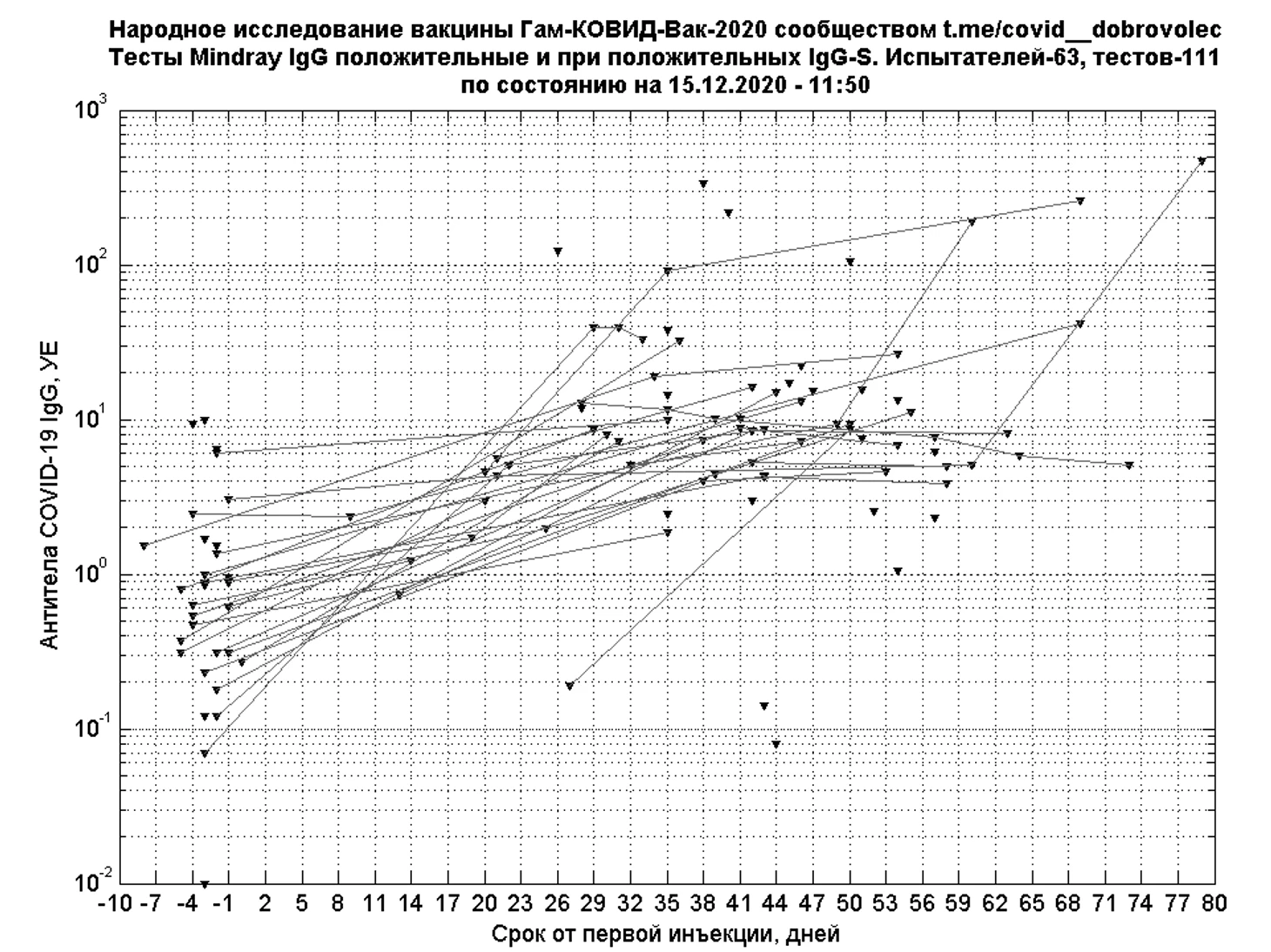
Для более редких полуколичественных тестов IgG к S-белку или RBD также построены временные картины иммуногенности при положительных и переходных результатах.